در سپهر بیولوژی انسانی و پاتوفیزیولوژی دستگاه تنفس، همپوشانی علائم بالینی میان رینیت آلرژیک فصلی (حساسیت بهاره) و عفونتهای ویروسی دستگاه تنفس فوقانی (سرماخوردگی) یکی از پیچیدهترین چالشهای تشخیصی برای کادر درمان و بیماران به شمار میرود. با آغاز فصل بهار و پراکندگی گردههای گیاهی در اتمسفر، سیستم ایمنی افراد مستعد، واکنشی افراطی به مواد بیآزار محیطی نشان میدهد که در ظاهر شباهت عجیبی به نبرد بدن با ویروسهای مهاجم دارد. با این حال، در سطوح سلولی و مولکولی، این دو وضعیت در دو قطب کاملاً متفاوت از پاسخهای ایمنی قرار میگیرند. در حالی که سرماخوردگی محصول تهاجم پاتوژنهای خارجی و پاسخ ایمنی ذاتی و اختصاصی برای حذف ویروس است، حساسیت بهاره نتیجه یک خطای سیستمیک در تشخیص «خود» از «غیرخودِ بیخطر» است که منجر به التهاب مزمن و آسیبهای بافتی ناخواسته میشود. این گزارش تحلیلی با نگاهی ژرف به شاخصهای آزمایشگاهی نظیر ایمونوگلوبولین E (IgE) و نقش ائوزینوفیلها، به تبیین تمایزهای ساختاری این دو عارضه میپردازد.
تبارشناسی اتیولوژیک: ویروس در برابر آلرژن
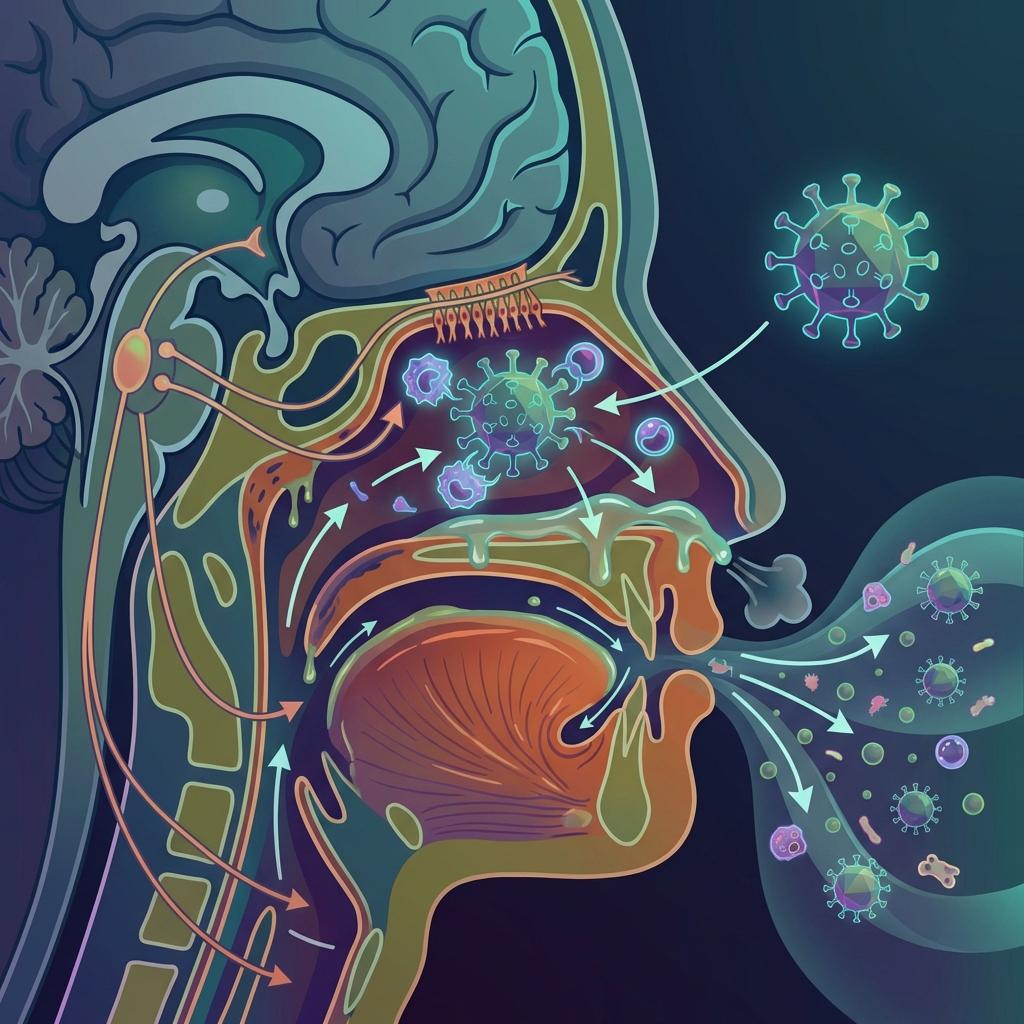
بنیاد تفاوت این دو عارضه در عامل محرک نهفته است. سرماخوردگی معمولی یک بیماری عفونی واگیردار است که توسط بیش از ۲۰۰ نوع ویروس مختلف، از جمله رینوویروسها (Rhinoviruses)، کوروناویروسهای انسانی و ویروس سنسشیال تنفسی (RSV) ایجاد میشود. این ویروسها با اتصال به گیرندههای سلولی در مخاط بینی و گلو، فرآیند تکثیر را آغاز کرده و منجر به تخریب سلولهای اپیتلیال و فراخوانی سلولهای التهابی نظیر نوتروفیلها میشوند.
در نقطه مقابل، حساسیت بهاره یا تب یونجه (Hay Fever)، یک واکنش پاتولوژیک از نوع حساسیت تیپ یک (Type I Hypersensitivity) است. در این فرآیند، ذرات پروتئینی موجود در گرده درختان، علفها و چمنها (آلرژنها) به عنوان یک آنتیژن مهاجم توسط لنفوسیتهای B شناسایی شده و تحت تأثیر سیتوکینهای مترشحه از لنفوسیتهای Th2، تولید انبوه پادتن IgE اختصاصی کلید میخورد. این تفاوت بنیادی در منشأ بیماری، مسیرهای تشخیصی و درمانی کاملاً مجزایی را میطلبد.
| ویژگی ساختاری | سرماخوردگی معمولی | حساسیت بهاره (آلرژی فصلی) |
|---|---|---|
| عامل ایجادکننده | ویروسها (عمدتاً رینوویروس) | آلرژنها (گرده گیاهان، مایت، کپک) |
| مکانیسم ایمنی | پاسخ ایمنی ضد ویروسی (Innate & Adaptive) | واکنش پاتولوژیک IgE و ماستسلها |
| قابلیت انتقال | بسیار مسری (قطرات تنفسی و تماس) | غیر واگیر (ژنتیکی و محیطی) |
| الگوی تکرار | تصادفی (بیشتر در زمستان) | فصلی و قابل پیشبینی (بهار و پاییز) |
کالبدشکافی نشانهشناسی بالینی
تمایز بالینی میان این دو عارضه نیازمند بررسی دقیق دینامیک علائم است. سرماخوردگی معمولاً یک سیر تکاملی را طی میکند؛ علائم به تدریج ظاهر شده و طی ۷ تا ۱۰ روز فروکش میکنند. اما در آلرژی، علائم بلافاصله پس از مواجهه با آلرژن بروز کرده و تا زمانی که عامل محرک در محیط حضور دارد، تداوم مییابند که ممکن است هفتهها یا ماهها به طول انجامد.
یکی از شاخصترین تفاوتها، وجود «خارش» است. خارش شدید در چشمها، بینی، گوشها و سقف دهان از ویژگیهای اختصاصی رینیت آلرژیک است که ناشی از آزادسازی هیستامین در بافتهای مخاطی است. در سرماخوردگی، خارش به ندرت دیده میشود و در عوض، «گلودرد» دردناک و التهابی که بلع را دشوار میکند، علامت غالب است. همچنین، ماهیت ترشحات بینی در تشخیص بسیار راهگشا است. در آلرژی، مخاط بینی همواره شفاف، رقیق و آبکی باقی میماند، اما در سرماخوردگی، ترشحات پس از چند روز تغییر ماهیت داده و به دلیل حضور گلبولهای سفید و بقایای سلولی، غلیظ، زرد یا سبز رنگ میشوند.
نقش کلیدی ایمونوگلوبولین E در پاتولوژی آلرژی
ایمونوگلوبولین E (IgE) پروتئینی است که در مرکز ثقل پاسخهای آلرژیک قرار دارد. این آنتیبادی که با وزن مولکولی حدود 190 kDa شناخته میشود، دارای زنجیرههای سنگین اپسیلون (ε) است که ویژگیهای بیولوژیک منحصر به فردی به آن میبخشد. در افراد غیرآلرژیک، سطح IgE در سرم خون بسیار ناچیز است، اما در افراد مبتلا به حساسیت بهاره، این مقدار به شدت افزایش مییابد.
مکانیسم حساسسازی و دگرانولاسیون
فرآیند پاتولوژیک با اتصال IgE به گیرندههای با تمایل بالا (FcεRI) بر سطح ماستسلها و بازوفیلها آغاز میشود. هنگامی که فرد مجدداً در معرض گردههای بهاری قرار میگیرد، آلرژنها باعث ایجاد پیوند عرضی (Cross-linking) میان مولکولهای IgE سطحی شده و سیگنالدهی داخل سلولی برای آزادسازی واسطههای التهابی از پیش ساخته شده نظیر هیستامین، پروتئازها و فاکتورهای کموتاکتیک را فعال میکنند. این فرآیند دگرانولاسیون، مسئول بروز آنی علائم عطسه و آبریزش است.
در آزمایشگاه تشخیص پزشکی سلامت، سنجش IgE به دو روش کلی انجام میشود:
- سنجش IgE تام (Total IgE): اندازهگیری کل مقدار این پادتن در خون که افزایش آن نشاندهنده وضعیت آتوپیک است، اما منبع حساسیت را مشخص نمیکند.
- سنجش IgE اختصاصی (Specific IgE): شناسایی واکنش بدن به آلرژنهای معین نظیر گرده بید، چمن یا مایت غبار.
ائوزینوفیلها: سربازان پیادهنظام التهاب مزمن
ائوزینوفیلها نوعی گلبول سفید گرانولوسیت هستند که نام خود را از تمایل شدید به رنگ اسیدی ائوزین گرفتهاند. در حالی که نوتروفیلها در خط مقدم مبارزه با باکتریها و ویروسهای سرماخوردگی قرار دارند، ائوزینوفیلها متخصص پاسخ به انگلها و واکنشهای آلرژیک هستند. در جریان حساسیت بهاره، تحت تأثیر سیتوکینهایی مانند IL-5، ائوزینوفیلها از مغز استخوان آزاد شده و به سمت مخاط تنفسی فراخوانده میشوند.
حضور ائوزینوفیلها در بافت، فاز تأخیری واکنش آلرژیک را رقم میزند. این سلولها با آزادسازی پروتئینهای سمی نظیر پروتئین پایه اصلی (MBP) و پراکسیداز ائوزینوفیلی (EPO)، باعث تخریب لایه اپیتلیال مجاری تنفسی و ایجاد تورم پایدار میشوند. افزایش شمار ائوزینوفیلها در آزمایش خون (CBC) که به آن ائوزینوفیلی گفته میشود، یکی از دقیقترین نشانههای آزمایشگاهی برای افتراق آلرژی از سرماخوردگی است.
| سطح ائوزینوفیلی | تعداد مطلق (سلول در هر میکرولیتر) | تفسیر بالینی |
|---|---|---|
| نرمال | کمتر از ۵۰۰ | وضعیت فیزیولوژیک طبیعی |
| خفیف | ۵۰۰ تا ۱۵۰۰ | حساسیتهای فصلی و آلرژیهای خفیف |
| متوسط | ۱۵۰۰ تا ۵۰۰۰ | آسم فعال، عفونتهای انگلی یا اگزما |
| شدید | بیش از ۵۰۰۰ | سندرمهای هیپرائوزینوفیلیک و آسیب بافتی جدی |
روشهای تشخیص افتراقی در آزمایشگاه سلامت
آزمایشگاه تشخیص پزشکی سلامت با بهرهگیری از پروتکلهای نوین، به منظور پایان دادن به تردیدهای بالینی، مجموعهای از تستهای تخصصی را ارائه میدهد. تشخیص قطعی بر پایه تلفیق تاریخچه بیمار و نتایج آزمایشگاهی استوار است.
۱. آزمایش شمارش کامل خون (CBC) و دیفرانسیل
در سرماخوردگی، ممکن است تعداد کل گلبولهای سفید (WBC) کمی افزایش یابد و لنفوسیتها یا نوتروفیلها غالب باشند. اما در حساسیت بهاره، درصد ائوزینوفیلها معمولاً از مرز ۶ درصد فراتر رفته و تعداد مطلق آنها افزایش مییابد.
۲. بررسی سیتولوژی سواب بینی
یکی از روشهای بسیار ارزشمند و کمهزینه برای تفکیک آلرژی از عفونت، بررسی گسترده مخاط بینی است. حضور ائوزینوفیلهای فراوان در مخاط بینی تأییدی بر رینیت آلرژیک است، در حالی که مشاهده نوتروفیلهای دژنره و باکتریها، نشاندهنده یک فرآیند عفونی یا سرماخوردگی است.
۳. پنلهای نوین آلرژی (Alex Test)
تست الکس (ALEX²) پیشرفتهترین روش تشخیصی در دنیاست که به طور همزمان ۳۰۰ آلرژن مختلف (شامل گردهها، غذاها، حشرات و مایتها) را بررسی میکند. این تست با اندازهگیری IgE اختصاصی در سطح مولکولی، نه تنها نوع حساسیت را مشخص میکند، بلکه احتمال واکنشهای متقاطع (Cross-reactivity) را نیز تحلیل مینماید.
۴. تستهای پوستی (Prick Test)
در این روش، مقدار ناچیزی از عصاره آلرژنها به لایه اپیدرم پوست وارد میشود. ایجاد کهیر و قرمزی در محل تست ظرف ۲۰ دقیقه، نشاندهنده وجود IgE اختصاصی متصل به ماستسلهای پوستی است.
اهمیت بالینی تشخیص صحیح: فراتر از یک عطسه ساده
تمایز میان این دو وضعیت تنها یک بحث آکادمیک نیست، بلکه پیامدهای درمانی عمیقی دارد. مدیریت نادرست حساسیت بهاره و انگاشت آن به عنوان یک سرماخوردگی مزمن، منجر به مصرف بیرویه آنتیبیوتیکها میشود که هیچ نقشی در درمان آلرژی ندارند و تنها به مقاومت دارویی دامن میزنند.
از سوی دیگر، حساسیتهای بهاره درماننشده میتوانند به عوارض جدیتری منجر شوند:
- توسعه آسم آلرژیک: التهاب ناشی از ائوزینوفیلها در مجاری فوقانی میتواند به مجاری تحتانی گسترش یافته و باعث تنگی نفس و خسخس سینه شود.
- سینوزیت مزمن: انسداد مجاری سینوسها ناشی از تورم آلرژیک، بستر را برای عفونتهای باکتریایی ثانویه فراهم میکند.
- کاهش کیفیت زندگی: اختلال خواب ناشی از احتقان بینی، منجر به خستگی مفرط، تحریکپذیری و کاهش عملکرد شناختی در محیط کار یا تحصیل میگردد.
رویکردهای درمانی مبتنی بر تشخیص آزمایشگاهی
پس از تأیید منشأ علائم در آزمایشگاه، استراتژیهای درمانی متمایز میشوند. سرماخوردگی نیازمند درمانهای حمایتی نظیر استراحت، هیدراتاسیون و مسکنهای عمومی است و دوره آن خودبهخود محدودشونده است. اما آلرژی نیازمند مدیریت فعال است.
درمانهای رایج آلرژی بر اساس نتایج آزمایشگاهی شامل موارد زیر است:
- آنتیهیستامینها: برای مهار اثر هیستامین آزادشده در فاز زودرس.
- کورتیکواستروئیدهای داخل بینی: مؤثرترین درمان برای کاهش التهاب بافتی و مهار فعالیت ائوزینوفیلها.
- ایمونوتراپی (واکسن آلرژی): تنها روش درمانی که با هدف قرار دادن سیستم ایمنی و تغییر پاسخ IgE به سمت IgG4، باعث تحملپذیری نسبت به آلرژن میشود.
- آنتیبادیهای مونوکلونال (Anti-IgE): داروهای پیشرفته نظیر اومالیزوماب که با متصل شدن به IgE آزاد در خون، مانع از اتصال آن به ماستسلها و تحریک ائوزینوفیلها میشوند.
توصیههای پیشگیرانه و مراقبتی
آزمایشگاه تشخیص پزشکی سلامت به مراجعانی که در فصول بهار و پاییز دچار علائم تنفسی میشوند، توصیه میکند پیش از هرگونه اقدام درمانی، با انجام یک تست CBC ساده و سنجش سطح IgE، از ماهیت بیماری خود آگاه شوند. همچنین رعایت نکات زیر میتواند در کاهش بار آلرژنها مؤثر باشد:
- استفاده از ماسکهای فیلتردار در روزهایی که غلظت گرده گیاهان بالاست.
- شستشوی مداوم مجاری بینی با محلولهای نمکی (نرمال سالین) برای خارج کردن آلرژنها از مخاط.
- انجام آزمایشهای دورهای برای پایش سطح ائوزینوفیلها در افراد مبتلا به آسم.
جمعبندی تحلیلی
تفاوت میان حساسیت بهاره و سرماخوردگی در حقیقت تقابل میان یک عفونت گذرا و یک اختلال ایمونولوژیک پایدار است. در حالی که سرماخوردگی با تکیه بر قدرت دفاعی بدن بهبود مییابد، حساسیت بهاره نیازمند درک دقیق مکانیسمهای سلولی است که در آن IgE به عنوان کلید فعالساز و ائوزینوفیلها به عنوان عاملان اصلی التهاب عمل میکنند.
آزمایشگاه تشخیص پزشکی سلامت با ارائه دقیقترین ابزارهای تشخیصی، از سنجش ساده ائوزینوفیل تا تحلیل مولکولی آلرژنها، همراه شماست تا با تشخیصی درست، مسیری کوتاه و مؤثر به سوی سلامتی و آرامش تنفس برگزینید. تشخیص دقیق، نه تنها یک نیاز پزشکی، بلکه اولین گام برای رهایی از بند علائم آزاردهندهای است که میتواند زیباییهای فصل بهار را در سایه خود قرار دهد.