آیا همیشه احساس خستگی میکنید، حتی پس از یک خواب کامل شبانه؟ آیا تمرکز کردن برایتان دشوار شده یا با کوچکترین فعالیتی دچار تنگی نفس میشوید؟ اینها شاید فقط نشانههای یک روز پرمشغله نباشند، بلکه علائم خاموش یک مشکل شایع اما جدی به نام کمخونی ناشی از فقر آهن باشند.
کمخونی یکی از شایعترین اختلالات خونی در سراسر جهان است که میلیونها نفر را تحت تأثیر قرار میدهد. اما خبر خوب این است که تشخیص آن با یک آزمایش خون ساده امکانپذیر است و در اغلب موارد بهراحتی درمان میشود. در این مقاله، به بررسی جامع علائم، دلایل و مهمتر از همه، روشهای تشخیصی این بیماری میپردازیم.

کمخونی چیست؟ یک توضیح ساده
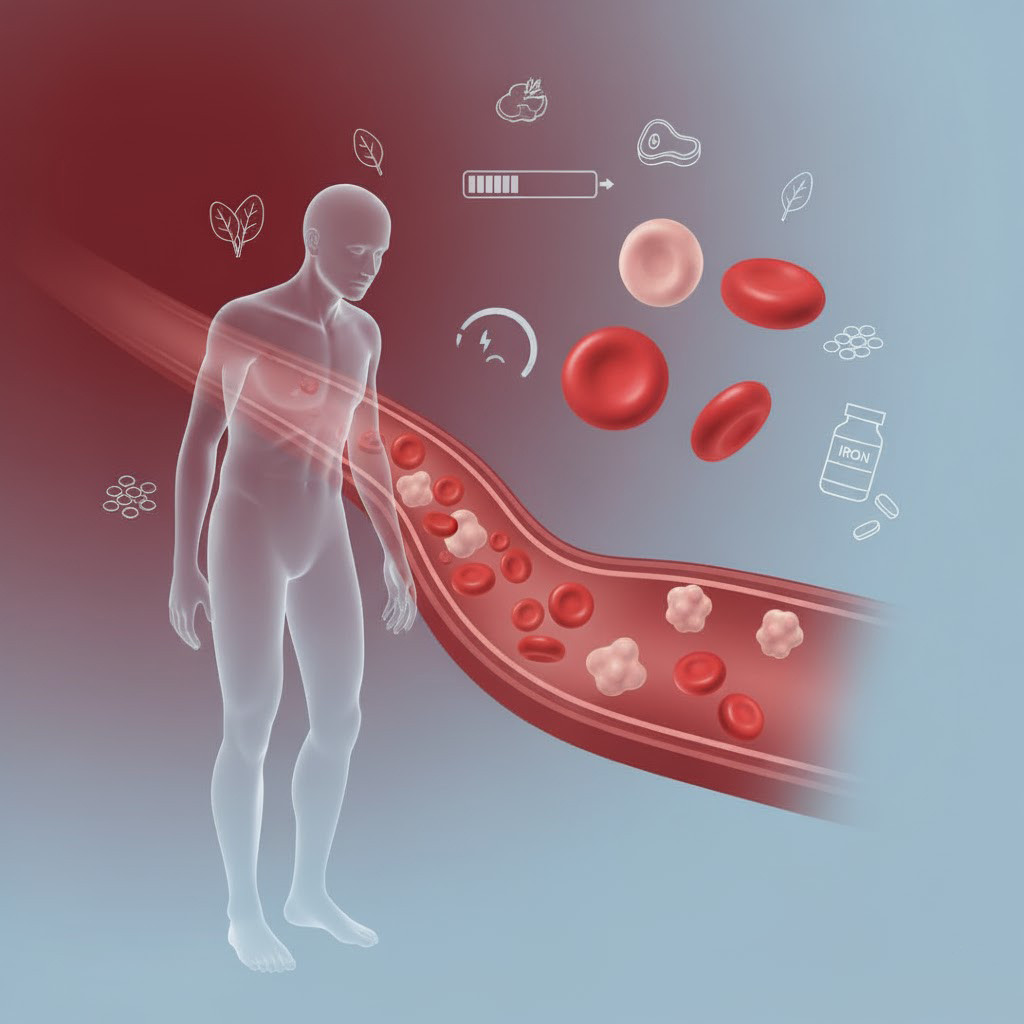
خون ما از سلولهای مختلفی تشکیل شده است که یکی از مهمترین آنها، گلبولهای قرمز هستند. وظیفه اصلی این سلولها، حمل اکسیژن از ریهها به تمام اندامهای بدن است. این کار توسط پروتئینی به نام هموگلوبین انجام میشود که برای ساخت آن، بدن به مادهای حیاتی به نام آهن نیاز دارد.
کمخونی (Anemia) زمانی اتفاق میافتد که تعداد گلبولهای قرمز سالم یا میزان هموگلوبین در خون شما از حد طبیعی کمتر شود. در این حالت، اکسیژنرسانی به بافتهای بدن مختل شده و علائم مختلفی بروز میکند.
فقر آهن، شایعترین مقصر کمخونی
انواع مختلفی از کمخونی وجود دارد، اما شایعترین نوع آن در سراسر جهان، کمخونی ناشی از فقر آهن (Iron Deficiency Anemia) است. همانطور که از نامش پیداست، این نوع کمخونی زمانی رخ میدهد که بدن شما به اندازه کافی آهن برای تولید هموگلوبین در اختیار نداشته باشد.
دلایل اصلی فقر آهن عبارتاند از:
- رژیم غذایی نامناسب: عدم مصرف کافی غذاهای سرشار از آهن.
- خونریزی: خونریزیهای شدید در دوران قاعدگی، زخمهای داخلی یا اهدای خون مکرر.
- مشکلات جذب: برخی بیماریها مانند سلیاک میتوانند مانع جذب آهن در روده شوند.
- نیاز افزایشیافته بدن: در دوران بارداری یا رشد سریع در نوجوانی، نیاز بدن به آهن بیشتر میشود.
علائم خاموش کمخونی که نباید نادیده بگیرید
بسیاری از علائم کمخونی غیراختصاصی هستند و ممکن است با استرس یا خستگی روزمره اشتباه گرفته شوند. به همین دلیل به آنها “علائم خاموش” میگویند. اگر چند مورد از نشانههای زیر را بهطور مداوم تجربه میکنید، بهتر است به آن توجه کنید:
- خستگی و ضعف شدید و غیرعادی: این شایعترین علامت است. احساس میکنید انرژی کافی برای انجام کارهای روزمره را ندارید.
- رنگپریدگی پوست، لبها و پلکها: کاهش هموگلوبین باعث میشود رنگ خون کمتر قرمز باشد و پوست رنگپریده به نظر برسد.
- سرگیجه و سردردهای مکرر: نرسیدن اکسیژن کافی به مغز میتواند این علائم را ایجاد کند.
- تنگی نفس: با کوچکترین فعالیتی مانند بالا رفتن از پلهها، نفس کم میآورید.
- تپش قلب: قلب برای جبران کمبود اکسیژن، مجبور است سریعتر کار کند.
- دست و پاهای سرد: کاهش جریان خون غنی از اکسیژن باعث سردی انتهای بدن میشود.
- ناخنهای شکننده و قاشقی شکل: در موارد شدید، ناخنها ضعیف، شکننده و حتی گود میشوند.
- ریزش مو: کمبود آهن میتواند یکی از دلایل ریزش مو باشد.
- هوسهای عجیب (پیکا): تمایل به خوردن مواد غیرخوراکی مانند یخ، خاک یا گچ.
تشخیص دقیق با آزمایش خون: کلید سلامتی شما
اگر به کمخونی مشکوک هستید، به هیچ وجه خوددرمانی نکنید. مصرف خودسرانه مکمل آهن میتواند خطرناک باشد. بهترین و مطمئنترین راه برای تشخیص قطعی، مراجعه به پزشک و انجام آزمایش خون است. دو آزمایش کلیدی برای تشخیص کمخونی فقر آهن عبارتاند از:
۱. آزمایش شمارش کامل خون (CBC)
این یک آزمایش استاندارد است که اطلاعات کلی در مورد سلولهای خونی شما ارائه میدهد. در این آزمایش، پارامترهای زیر برای کمخونی بررسی میشوند:
- هموگلوبین (Hb): سطح پروتئین حملکننده اکسیژن را اندازهگیری میکند.
- هماتوکریت (Hct): درصد گلبولهای قرمز در حجم کل خون را نشان میدهد.
- MCV (Mean Corpuscular Volume): میانگین حجم گلبولهای قرمز را نشان میدهد. در فقر آهن، گلبولهای قرمز معمولاً کوچکتر از حد طبیعی هستند.
۲. آزمایش فریتین (Ferritin)
فریتین پروتئینی است که آهن را در سلولهای بدن ذخیره میکند. سطح فریتین در خون، نشاندهنده میزان ذخایر آهن بدن شماست. این آزمایش بسیار مهم است، زیرا سطح فریتین حتی قبل از اینکه سطح هموگلوبین شما افت کند، کاهش مییابد. بنابراین، پایین بودن فریتین یکی از اولین و قطعیترین نشانههای فقر آهن است.
درمان و پیشگیری
پس از تشخیص قطعی توسط پزشک، درمان معمولاً شامل موارد زیر است:
- مصرف مکمل آهن: پزشک دوز مناسب مکمل آهن را برای شما تجویز میکند.
- اصلاح رژیم غذایی: مصرف غذاهای سرشار از آهن مانند گوشت قرمز، مرغ، ماهی، حبوبات (عدس و لوبیا)، سبزیجات با برگ تیره (اسفناج) و میوههای خشک.
- افزایش جذب آهن: مصرف ویتامین C (مانند آب پرتقال) همراه با منابع آهن، به جذب بهتر آن کمک میکند.
- درمان علت زمینهای: اگر کمخونی به دلیل بیماری دیگری ایجاد شده باشد، درمان آن بیماری ضروری است.
سخن پایانی: به بدن خود گوش دهید
کمخونی فقر آهن یک مشکل جدی است که میتواند کیفیت زندگی شما را بهشدت تحت تأثیر قرار دهد. علائم خاموش آن را نادیده نگیرید. اگر احساس خستگی مزمن، سرگیجه، رنگپریدگی یا سایر علائم ذکرشده را دارید، حتماً با پزشک مشورت کنید. یک آزمایش خون ساده میتواند بهسرعت مشکل را تشخیص دهد و شما را در مسیر بهبودی و بازیابی انرژی و سلامتی کامل قرار دهد.