فیلاریازیس (Filariasis) چیست؟ علل، علائم، تشخیص و روشهای درمان
فیلاریازیس نوعی بیماری انگلی است که از طریق برخی بندپایان ناقل (نظیر پشهها) منتقل میشود و
میتواند باعث بروز مشکلات جدی ازجمله الفانتیازیس و آسیبهای لنفاوی شود. در این مقاله از
آزمایشگاه تشخیص پزشکی سلامت با علل، علائم، روشهای تشخیص و درمان فیلاریازیس بیشتر آشنا شوید.
مقدمه
فیلاریازیس مجموعهای از بیماریهای انگلی است که نهتنها انسان بلکه حیوانات را نیز درگیر
میکند. این عفونتها که عمدتاً توسط کرمهای نماتد از راسته Filariidae ایجاد
میشوند، شامل فیلاریاز لنفاوی، انکوسرسیازیس، لوئیازیس و مانسونلوز هستند. آمارها نشان
میدهد حدود ۲۰۰ میلیون نفر در سراسر جهان به این بیماری مبتلا هستند که بیشتر آنها در
کشورهای در حال توسعه زندگی میکنند.
در این مقاله از آزمایشگاه تشخیص پزشکی سلامت به بررسی طبقهبندی فیلاریازیس، چرخه زندگی انگل،
اپیدمیولوژی، علائم، روشهای تشخیص و درمان و همچنین راههای پیشگیری از آن میپردازیم.
طبقهبندی فیلاریازیس
کرمهای فیلاریایی معمولاً بر اساس محل زندگی کرمهای بالغ در بدن انسان طبقهبندی میشوند:
گروه پوستی:
- Loa loa
- Onchocerca volvulus
- Mansonella streptocerca
گروه لنفاوی:
- Wuchereria bancrofti
- Brugia malayi
- Brugia timori
گروه حفره بدنی:
- Mansonella perstans
- Mansonella ozzardi
از بین این گروهها، فیلاریازیس پوستی و لنفاوی بیشترین اهمیت بالینی را دارند. صدها انگل
فیلاریایی شناسایی شدهاند، اما تنها ۸ گونه موجب بیماری در انسان میشوند. برخی گونههای دیگر
ممکن است عفونت ناقص ایجاد کنند اما قادر به تکمیل چرخه زندگی در انسان نیستند.
چرخه زندگی فیلاریازیس لنفاوی
چرخه زندگی انگلهای فیلاریایی (مانند سایر نماتدها) شامل پنج مرحله رشدی یا لاروی است که در دو
میزبان (یک میزبان مهرهدار مانند انسان و یک بندپای ناقل مانند پشه یا مگس) طی میشود:
- کرمهای ماده بالغ هزاران لارو مرحلهی اول (میکروفیلاریا) تولید میکنند.
- این میکروفیلاریاها هنگام خونخواری توسط حشره ناقل (پشه یا مگس) وارد بدن آن میشوند.
- میکروفیلاریا در بدن حشره دو مرحله رشد را طی میکند و به لارو مرحله سوم تبدیل میشود.
-
هنگامی که حشره ناقل دوباره خونخواری میکند، لارو مرحله سوم را به میزبان مهرهدار (انسان)
منتقل میکند. -
در انسان، دو مرحله پایانی رشد طی شده و کرمهای بالغ در سیستم لنفاوی یا پوست مستقر
میشوند.
ریتم شبانهروزی: بسیاری از گونههای فیلاریایی دارای یک الگوی گردش خون خاص
هستند (ریتم شبانهروزی). حداکثر غلظت میکروفیلاریا در خون محیطی زمانی ظاهر میشود که حشره ناقل
(محلی) بیشترین فعالیت خونخواری را دارد.
اپیدمیولوژی
برنامه جهانی ریشهکنی فیلاریازیس لنفاوی (GPELF) از سال ۱۹۹۷ با هدف ریشهکن کردن فیلاریازیس
لنفاوی بهعنوان یک مشکل بهداشت عمومی آغاز شد. در این راستا، بیش از ۱.۷ میلیارد دُز دارو تحت
عنوان شیمیدرمانی پیشگیرانه (MDA) ارائه شده است. سازمان جهانی بهداشت (WHO) نیز
دستورالعملهایی برای توقف درمان در کشورهای مختلف و بررسی آستانه انتقال (TAS) منتشر کرده
است.
-
تاکنون (تا اکتبر ۲۰۱۸) ۱۴ کشور به آستانه ریشهکنی رسیدهاند و حدود ۵۵۴ میلیون نفر از چرخهی
طولانی درمان بینیاز شدهاند. - ۸۶۳ میلیون نفر در ۴۷ کشور همچنان در معرض خطرند و نیاز به شیمیدرمانی پیشگیرانه دارند.
-
بیش از ۶.۷ میلیارد درمان انباشته از سال ۲۰۰۰ میلادی برای پیشگیری از گسترش عفونت ارائه شده
است. -
تخمین زده میشود که با شروع برنامههای WHO در سال ۲۰۰۰، آلودگی به این انگل حدود ۷۴ درصد
کاهش یافته و تا سال ۲۰۱۸ حدود ۵۱ میلیون نفر مبتلا باقی ماندهاند. - ۶۹۲ میلیون نفر به دلیل استراتژیهای موفق WHO دیگر نیازی به شیمیدرمانی پیشگیرانه ندارند.
عامل و ناقلهای فیلاریازیس لنفاوی
فیلاریازیس لنفاوی توسط سه نماتد زیر ایجاد میشود:
Wuchereria bancrofti (حدود ۹۰ درصد موارد)، Brugia malayi و Brugia timori.
مهمترین ناقلان این انگلها پشههایی از جنسهای Aedes، Anopheles،
Culex و Mansonia هستند.
علائم فیلاریازیس
علائم بیماری معمولاً به علت واکنش میزبان به کرمهای بالغ در غدد لنفاوی و بافتها بروز
میکند. بهطور کلی سه سناریوی بالینی وجود دارد:
۱) عفونت بدون علامت
- در مناطق بومی رایج است.
- میکروفیلاریا در اسمیر خون محیطی مشاهده میشود اما بیمار علامت بالینی ندارد.
-
باوجوداین، تغییرات لنفاوی برگشتناپذیر ممکن است بهمرور ایجاد شود و بر اهمیت تشخیص و
درمان این بیماران تأکید میکند.
۲) عفونت حاد
شامل دو فرم اصلی است:
-
ADL (آدنولنفانژیت حاد): شایعترین تظاهر حاد با تب و لنفادنوپاتی دردناک در
کشالهی ران و زیر بغل. معمولاً با عفونتهای باکتریایی ثانویه همپوشانی دارد و تکرار آن ادم
لنفاوی را بدتر میکند. -
AFL (لنفانژیت حاد فیلاریایی): کمتر شایع است و اغلب به دلیل مرگ خودبهخودی
یا ناشی از درمان کرمهای بالغ ایجاد میشود. با تودههای حساس کوچک در محل مرگ کرمها مشخص
میگردد.
۳) عفونت مزمن
-
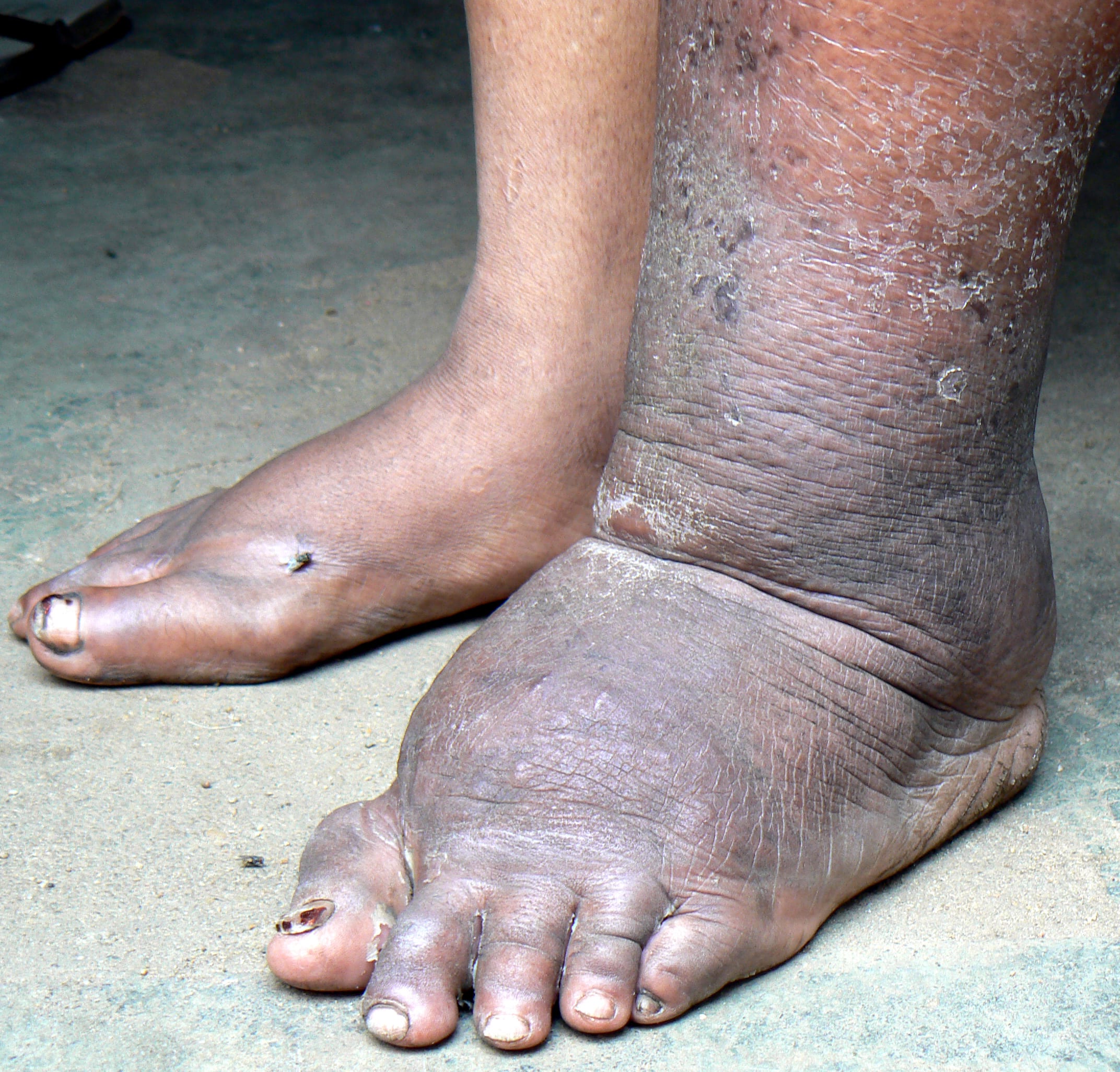
مهمترین تظاهرات آن شامل ادم لنفاوی، الفانتیازیس (فیلاریازیس مزمن) و ضایعات سیستم ادراری
تناسلی است. - اندام تحتانی بیشترین درگیری را دارد و تورم آن میتواند به الفانتیازیس تبدیل شود.
-
هیدروسل (تجمع مایع در کیسه بیضه)، شیلوسل، کیلوری (Chyluria) و آسیت کیلوس نیز
ممکن است دیده شوند. -
ائوزینوفیلی ریوی استوایی (Tropical Pulmonary Eosinophilia) نیز یک فرم پنهان است که با سرفه
خشک، خسخس سینه، تنگی نفس و گاهی کاهش وزن همراه است.
روشهای تشخیص آزمایشگاهی
اسمیر خون محیطی
- شایعترین روش تشخیصی برای گونههای فیلاریاز لنفاوی است.
- نمونهگیری خون باید در ساعاتی که میکروفیلاریا در اوج گردش خون است انجام شود.
-
تجویز یک دوز پایین دیاتیلکاربامازین (DEC) گاهی برای افزایش شانس تشخیص میکروفیلاریا
توصیه میشود.
تستهای سرولوژیک (ایمونولوژی)
- شناسایی آنتیژن فیلاریایی در گردش با کیتهای تجاری امکانپذیر است.
- تستهای آنتیبادی نیز در دسترساند.
- افزایش IgE و IgG4 در عفونت فعال و ائوزینوفیلی در همهی اشکال فیلاریازیس مشاهده میشود.
- واکنش زنجیرهای پلیمراز (PCR) از حساسیت و ویژگی بالا برخوردار است.
بررسی ادرار
-
در موارد شک به فیلاریازیس لنفاوی، بررسی وجود کیلوری (Chyluria) در ادرار و مشاهده
میکروفیلاریا در رسوب ادرار کمککننده است.
تصویربرداری
-
سونوگرافی در شناسایی انسداد غدد لنفاوی کشاله ران و بیضه، و همچنین مشاهده حرکت کرمهای بالغ
در غدد لنفاوی بیضه مردان کاربرد دارد. - لنفوسینتیگرافی نیز برای بررسی تغییرات سیستم لنفاوی مورد استفاده قرار میگیرد.
درمان و کنترل فیلاریازیس لنفاوی
مراقبتهای عمومی
- استراحت در بستر، بالابردن اندام و بانداژ فشاری برای کنترل ادم لنفاوی.
-
برنامهی مراقبت از پوست پا (بهویژه فواصل بین انگشتان) برای جلوگیری از عفونت ثانویه
باکتریایی یا قارچی. - رعایت بهداشت فردی و استفاده از مواد ضدقارچ.
- درمان آنتیبیوتیکی طولانیمدت در موارد عودهای مکرر ADL.
درمان دارویی
-
دیاتیل کاربامازین (DEC): میکروفیلاریا را از بین میبرد و در برخی موارد بر
کرم بالغ اثر دارد. در ائوزینوفیلی ریوی استوایی دوره درمان ۲ تا ۳ هفته است. -
ایورمکتین (Ivermectin): بیشتر میکروفیلاریا را میکشد و تأثیر مستقیم اندکی
بر کرم بالغ دارد. -
آلبندازول (Albendazole): در درمانهای ترکیبی سالیانه یا دوبار در سال طبق
پروتکل WHO برای برخی مناطق توصیه میشود.
درمان ترکیبی (Triple-Drug Therapy)
بر اساس دستورالعمل جدید WHO در مناطق بدون انکوسرسیازیس، ترکیب سه داروی ایورمکتین،
دیاتیلکاربامازین و آلبندازول میتواند بیش از ۹۹٪ میکروفیلاریا را در ظرف چند هفته نابود
کند. این رویکرد باعث تسریع روند ریشهکنی در مناطقی است که انکوسرسیازیس (کوری رودخانه) در
آنها شایع نیست.
پیشگیری
-
پرهیز از گزش حشرات ناقل در مناطق اندمیک با استفاده از توری، اسپری حشرهکش و پوشش
مناسب. -
شیمیدرمانی پیشگیرانه (MDA) برای افراد ساکن مناطق پرخطر طبق دستورالعملهای سازمان جهانی
بهداشت. -
ارتقای آگاهی عمومی از اهمیت رعایت بهداشت فردی، شستشوی منظم پاها و سایر نقاط مستعد
عفونت.
جمعبندی
فیلاریازیس لنفاوی یکی از بیماریهای انگلی مهم در مناطق گرمسیری و نیمهگرمسیری جهان است که
میتواند منجر به بروز ناتوانیهای دائمی نظیر الفانتیازیس شود. بااینحال، تشخیص بهموقع و
بهرهمندی از رژیمهای درمانی مناسب (DEC، ایورمکتین، آلبندازول) در کنار رعایت اصول بهداشتی،
میتواند نقش چشمگیری در کنترل و حتی ریشهکنی آن ایفا کند.
اگر نگران ابتلا به فیلاریازیس هستید یا در منطقهای زندگی میکنید که این بیماری شیوع بیشتری
دارد، برای انجام آزمایشهای لازم و تشخیص قطعی، به آزمایشگاه تشخیص پزشکی سلامت مراجعه کنید.
متخصصان ما آماده ارائه مشاوره تخصصی و خدمات آزمایشگاهی دقیق به شما عزیزان هستند.
منبع:
این متن ترجمه فارسی مقالهای است که در اصل به زبان انگلیسی منتشر شده است:
Dr Colin Tidy, Lymphatic Filariasis.
Available from: patient.info/doctor
Last updated: 01/2023.